|
| |||
| Мышечная дистрофия Дюшенна, от которой страдает один из 3600-5000 новорожденных мальчиков, вызывается отсутствием дистрофина —
белка, который соединяет цитоскелет и внеклеточный матрикс в мышечном
волокне и обеспечивает его стабильность при сокращении (рис. 1). Из-за мутаций гена DMD рамка считывания при трансляции его мРНК сдвигается, и синтез белка преждевременно прекращается. Врожденная болезнь очень быстро прогрессирует: ее диагностируют в возрасте около четырех лет, а к 10 годам ребенку обычно уже нужна инвалидная коляска. Это происходит потому, что без дистрофина волокна повреждаются, и как только регенеративная способность мышечных волокон исчерпывается, они заменяются фиброзной и жировой тканями [1]. Как показывают исследования, когнитивные функции у ребенка тоже могут быть нарушены [2]. Больше 30 лет с таким заболеванием, как правило, не живут, а смерть наступает от сердечных и респираторных осложнений. Более мягкий вид миодистрофии, связанной с геном DMD, — это мышечная дистрофия Беккера, когда мутации не приводят к смещению рамки считывания [3]. Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека. 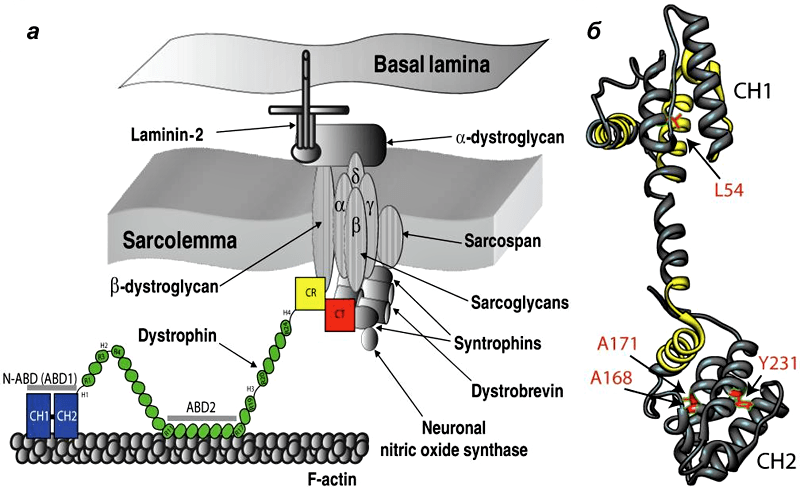 Рисунок 1. Мутации в дистрофине — причина развития миодистрофии Дюшенна. а - Дистрофин связывается с актиновыми филаментами (часть цитоскелета) через домены N-ABD и ABD2) и с ДАГК через домены CR и CT. б — Кристаллическая структура N-ABD дистрофина. Зоны связывания с актином показаны желтым, четыре хорошо изученных мутации, вызывающих заболевание, — красным. Рисунок из [18]. Рисунок 1. Мутации в дистрофине — причина развития миодистрофии Дюшенна. а - Дистрофин связывается с актиновыми филаментами (часть цитоскелета) через домены N-ABD и ABD2) и с ДАГК через домены CR и CT. б — Кристаллическая структура N-ABD дистрофина. Зоны связывания с актином показаны желтым, четыре хорошо изученных мутации, вызывающих заболевание, — красным. Рисунок из [18].Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным». 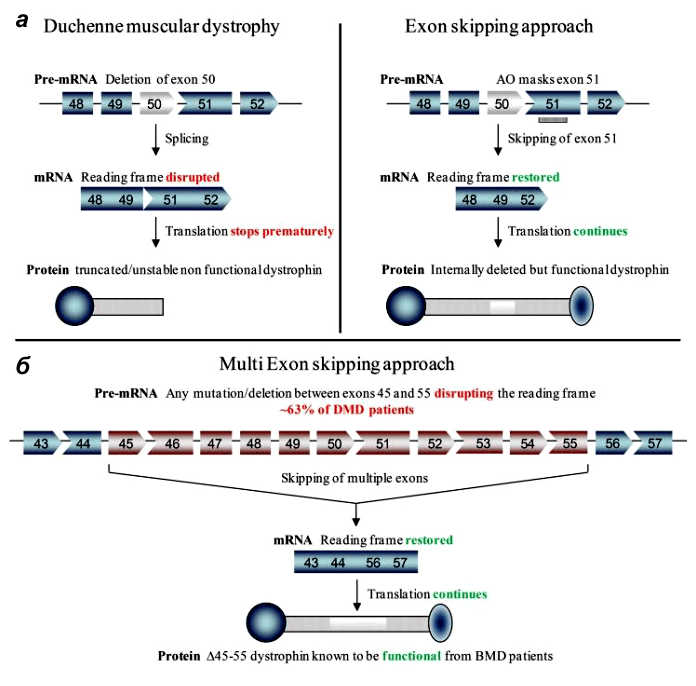 Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD
присутствуют мутации, нарушающие рамку считывания при синтезе белка.
Например, при делеции экзона 50 появляется «внерамочная» мРНК, что
приводит к синтезу усеченного нефункционального или нестабильного
дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б —
Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов
45–55, мутации которых встречаются примерно у 63% пациентов,
то образовавшийся короткий дистрофин приведёт к трансформации
стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип. Рисунок из [19]. Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD
присутствуют мутации, нарушающие рамку считывания при синтезе белка.
Например, при делеции экзона 50 появляется «внерамочная» мРНК, что
приводит к синтезу усеченного нефункционального или нестабильного
дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б —
Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов
45–55, мутации которых встречаются примерно у 63% пациентов,
то образовавшийся короткий дистрофин приведёт к трансформации
стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип. Рисунок из [19].Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9)* [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
* — Подробнее про эту методику, позаимствованную у бактерий, можно почитать в статьях: «CRISPR-системы: иммунизация прокариот», «Мутагенная цепная реакция: редактирование геномов на грани фантастики» и «А не замахнуться ли нам на ... изменение генома?» [11–13].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии. В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун. Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах. Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке? Терапия миодистрофии Дюшенна: старые и новые подходыПо словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?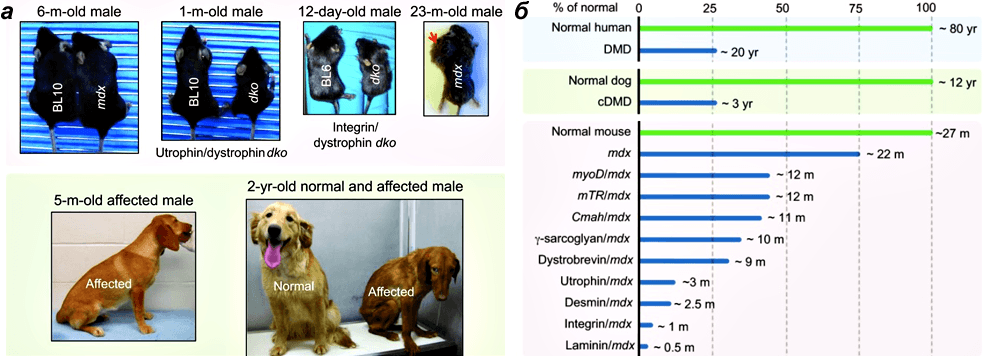 Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху:
у мышей mdx симптомы проявляются только в старости, и они склонны
к образованию рабдомиосарком — опухолей мышечного происхождения. Размер
мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина
значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей. Рисунок из [17]. Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху:
у мышей mdx симптомы проявляются только в старости, и они склонны
к образованию рабдомиосарком — опухолей мышечного происхождения. Размер
мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина
значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей. Рисунок из [17].Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3]. Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели. Такой массированный экспериментальный удар по миодистрофии Дюшенна вселяет надежду. Станет ли технология CRISPR/Cas9 ведущей в разработке терапии, которую смогут принять на вооружение клиницисты? Возможно, не за горами и публикации похожих работ по другим заболеваниям, где нужно избавиться от мутаций в одном-единственном гене? Это мы узнаем из ближайших выпусков Science (а также других почетных журналов). Литература
| |||
Темы
C
Cеквенирование
E
E1b1b
G
I
I1
I2
J
J1
J2
N
N1c
Q
R1a
R1b
Y-ДНК
Австролоиды
Альпийский тип
Америнды
Англия
Антропологическая реконструкция
Антропоэстетика
Арабы
Арменоиды
Армия Руси
Археология
Аудио
Аутосомы
Африканцы
Бактерии
Балканы
Венгрия
Вера
Видео
Вирусы
Вьетнам
Гаплогруппы
Генетика человека
Генетические классификации
Геногеография
Германцы
Гормоны
Графики
Греция
Группы крови
ДНК
Деградация
Демография в России
Дерматоглифика
Динарская раса
Дравиды
Древние цивилизации
Европа
Европейская антропология
Европейский генофонд
ЖЗЛ
Живопись
Животные
Звёзды кино
Здоровье
Знаменитости
Зодчество
Иберия
Индия
Индоарийцы
Интеръер
Иран
Ирландия
Испания
Исскуство
История
Италия
Кавказ
Канада
Карты
Кельты
Китай
Корея
Криминал
Культура Руси
Латинская Америка
Летописание
Лингвистика
Миграция
Мимикрия
Мифология
Модели
Монголоидная раса
Монголы
Мт-ДНК
Музыка для души
Мутация
Народные обычаи и традиции
Народонаселение
Народы России
Наши Города
Негроидная раса
Немцы
Нордиды
Одежда на Руси
Ориентальная раса
Основы Антропологии
Основы ДНК-генеалогии и популяционной генетики
Остбалты
Переднеазиатская раса
Пигментация
Политика
Польша
Понтиды
Прибалтика
Природа
Происхождение человека
Психология
РАСОЛОГИЯ
РНК
Разное
Русская Антропология
Русская антропоэстетика
Русская генетика
Русские поэты и писатели
Русский генофонд
Русь
США
Семиты
Скандинавы
Скифы и Сарматы
Славяне
Славянская генетика
Среднеазиаты
Средниземноморская раса
Схемы
Тохары
Тураниды
Туризм
Тюрки
Тюрская антропогенетика
Укрология
Уралоидный тип
Филиппины
Фильм
Финляндия
Фото
Франция
Храмы
Хромосомы
Художники России
Цыгане
Чехия
Чухонцы
Шотландия
Эстетика
Этнография
Этнопсихология
Юмор
Япония
генетика
интеллект
научные открытия
неандерталeц
Поиск по этому блогу
пятница, 4 марта 2016 г.
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Ярлыки:
Генетика человека,
Здоровье